Bảng tuần hoàn hóa học lớp 8, 9, 10 mới nhất
Chuyên mục: IT
Bảng tuần hoàn các nguyên tố hóa học lớp 8, lớp 9 và lớp 10 đầy đủ, mới nhất
Bảng tuần hoàn với tên gọi đầy đủ là bảng tuần hoàn các nguyên tố hóa học, còn được gọi là bảng tuần hoàn của Mendeleev). Đây được xem là một phương pháp liệt kê các nguyên tố hóa học dưới dạng bảng, dựa theo số nguyên tử, cấu hình electron và chu kỳ hóa học của chúng.
Thông thường các nguyên tố hóa học sẽ được biểu đạt theo thứ tự số nguyên tử tăng dần, thường được ghi kèm theo ký hiệu hóa học trong mỗi ô. Do đó, bạng chuẩn của bảng có các phần tử sẽ được sắp xếp thành 18 cột và 7 hàng, với hai hàng kép riêng biệt ở dưới cùng.
Bảng tuần hoàn là gì?
Bảng tuần hoàn được biết đến là bảng tuần hoàn các nguyên tố hóa học. Đây là một phương pháp liệt kê các nguyên tố hóa học dưới dạng bảng dựa trên số nguyên tử, tính chất hóa học và cấu hình điện tử của chúng.
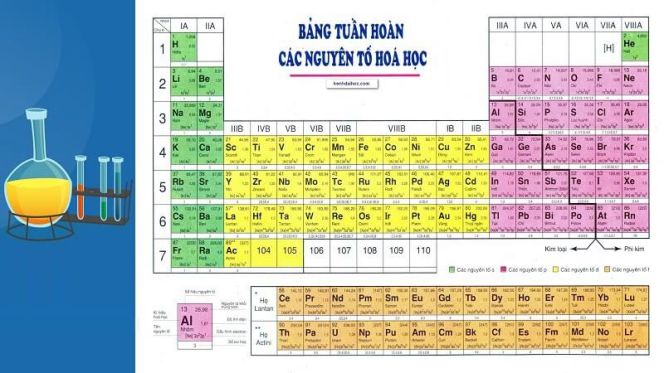
Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học? Các nguyên tố được biểu thị bằng số nguyên tử tăng dần và thường xuất hiện trong mỗi ô vuông với một ký hiệu hóa học. Hình dạng chuẩn của bảng nguyên tố hóa học gồm các nguyên tố được xếp thành 7 hàng và 18 cột, phía dưới có 2 hàng kép riêng biệt.
Bảng tuần hoàn hoàn chỉnh nhất được tạo ra bởi nhà hóa học người Nga Dmitri Ivanovich Mendeleev và được phát minh vào ngày 6 tháng 3 năm 1869.
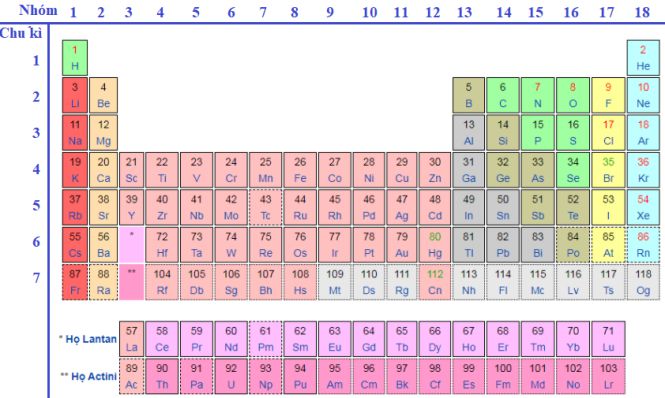
Cấu tạo của bảng tuần hoàn được chia làm 3 phần chính
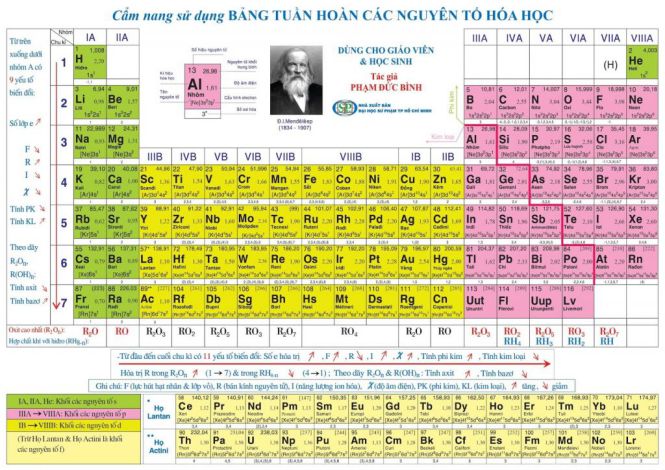
1. Ô nguyên tố
Cấu tạo của ô nguyên tố ghi số hiệu nguyên tử, kí hiệu hoá học, tên nguyên tố, nguyên tử khối được xác định theo nguyên tố đó.
Số lượng nguyên tử bằng số đơn vị điện tích hạt nhân và số electron trong nguyên tử. Do đó, số hiệu nguyên tử cũng là số thứ tự của nguyên tố ứng theo bảng tuần hoàn.
Ta lấy ví dụ: Số hiệu nguyên tử của Magie là 12 được biết đến như: Trong ô Magie 12, điện tích hạt nhân của nguyên tử Magie là 12+, trong Magie có 12 electron nguyên tử.
2. Chu kỳ
Chu kỳ được biết đến như là dãy các nguyên tố trong đó các nguyên tử có cùng lớp electron và sẽ sắp xếp theo chiều tăng dần điện tích hạt nhân.
Trong bảng tuần hoàn sẽ bao gồm 7 chu kỳ, các chu kỳ 1, 2, 3 được gọi là chu kỳ nhỏ và các chu kỳ 4, 5, 6, 7 được gọi là chu kỳ lớn.
3. Nhóm nguyên tố
Tập hợp các nguyên tố mà nguyên tử có cùng số electron ngoài cùng do đó có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử.
Số nhóm thứ tự bằng số electron ở lớp vỏ ngoài cùng của nguyên tử.
Có hai loại nhóm mặt hàng nguyên tố bao gồm nhóm A và nhóm B:
Nhóm A sẽ bao gồm các nguyên tố s và p. Số nhóm A = tổng số electron lớp ngoài cùng.
Nhóm B sẽ bao gồm các nguyên tố d và f, có cấu hình electron nguyên tử kết thúc ở dạng (n-1) dxnsy:
• Nếu (x+y) = 3 -> 7 thì nguyên tố thuộc nhóm (x+y)B.
• Nếu (x+y) = 8 -> 10 thì nguyên tố thuộc nhóm VIIIB.
• Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B
Bảng tuần hoàn hóa học có bao nhiêu nguyên tố?
Tính đến tháng 9 năm 2022, bảng tuần hoàn đã xác nhận 118 mục bao gồm các mục nguyên tố từ 1 (Hydro) đến 118 (Oganesson).
Ngoài việc công nhận nguyên tố 113 là một nguyên tố hóa học, Liên minh Quốc tế về Hóa học Cơ bản và Ứng dụng (IUPAC) cũng đã chính thức chỉ định ba nguyên tố khác có số hiệu nguyên tử lần lượt là 115, 117 và 118 trong bảng tuần hoàn. Đây là bản cập nhật chính của bảng tuần hoàn kể từ năm 2011, khi số 114 và 116 được giới thiệu và giờ đã đến chu kỳ thứ 7 bảng tuần hoàn đã được lấp đầy.
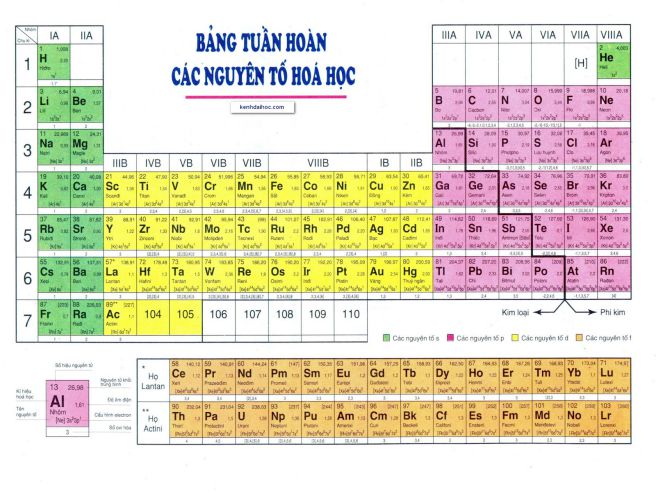
Sau khi phân tích nghiên cứu hóa học của các nhà khoa học Mỹ, Nhật Bản và Nga, IUPAC xác nhận rằng bốn nguyên tố có số hiệu nguyên tử 113, 115, 117 và 118 đáp ứng đầy đủ các tiêu chuẩn để trở thành nguyên tố mới. Đây là những nguyên tố nặng nhất của bảng tuần hoàn và chưa bao giờ được nhìn thấy tồn tại bên ngoài phòng thí nghiệm. Đó là, bởi vì chúng rất không ổn định, chúng chỉ có thể được tạo ra trong phòng thí nghiệm bằng cách tổng hợp từ các hạt nhân nhẹ, và trên thực tế tồn tại chưa đầy một giây trước khi bị hòa tan trong các nguyên tố.
Có thể thấy trong tổng số 118 nguyên tố hóa học thì có 98 nguyên tố xuất hiện trong tự nhiên, 20 nguyên tố còn lại từ Einstein đến Oganesson chỉ xuất hiện trong tổng hợp nhân tạo. Trong số 98 nguyên tố này, 84 nguyên tố là nguyên thủy, tức là những nguyên tố xuất hiện trước khi tạo ra Trái đất, và 14 nguyên tố còn lại chỉ xuất hiện trong chuỗi phân rã của các nguyên tố đầu tiên.
Hướng dẫn cách xem bảng tuần hoàn hóa học
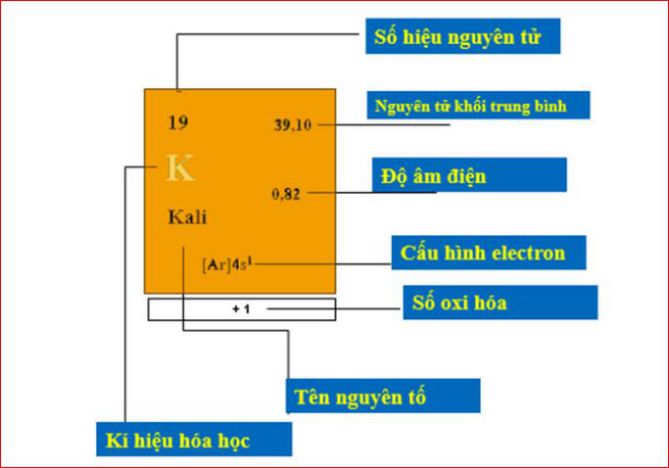
1. Số nguyên tử
Còn được gọi là số proton của một nguyên tố hóa học, nó là số proton được tìm thấy trong hạt nhân của một nguyên tử. Nó là số lượng điện tích hạt nhân, số hiệu nguyên tử giúp xác định một nguyên tố hóa học và số hiệu nguyên tử bằng số electron trong nguyên tử trung hoà về điện.
2. Nguyên tử khối trung bình
Hầu hết tất cả các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với một tỷ lệ phần trăm số nguyên tử cụ thể. Như vậy, nguyên tử khối của nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp đồng vị, tính thành phần trăm số nguyên tử tương ứng.
3. Độ âm điện
Độ âm điện của nguyên tử được biết đến với khả năng của nguyên tử đó hút các electron để tạo thành liên kết hóa học. Quy tắc độ âm điện của nguyên tử của nguyên tố càng lớn thì tính phi kim của nguyên tố càng mạnh và ngược lại.
4. Cấu hình electron
Cấu hình electron nguyên tử biểu thị sự phân bố electron trong vỏ nguyên tử ở các trạng thái năng lượng khác nhau hoặc trong các vùng hiện có.
5. Số oxi hóa
Số áp suất của nguyên tử hoặc nhóm nguyên tử, số oxi hóa cho phép chúng ta nói số electron trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng.
6. Tên nguyên tố
Một chất hóa học tinh khiết sẽ bao gồm một loại nguyên tử được phân biệt bằng số hiệu nguyên tử của nó, nghĩa là bằng số proton có trong mỗi hạt nhân.
7. Ký hiệu hóa học
Ký hiệu là tên viết tắt của một nguyên tố hóa học, ký hiệu của các nguyên tố hóa học thường bao gồm 1 hoặc 2 chữ cái trong bảng chữ cái Latinh và được viết bằng chữ in hoa. Các ký hiệu trước đây của các nguyên tố hóa học có nguồn gốc từ từ vựng tiếng La tinh và Hy Lạp cổ điển.
Mẹo đơn giản để học thuộc bảng tuần hoàn
Nhóm IA: Hai, Li Nào, Không, Rót, Cà, Fê (H, LI, NA, K, RB, CS, FR)
Nhóm IIA: Banh, Miệng, Cá Sấu, Bẻ, Răng (BE, MG, CA, SR, BA, RA)
Nhóm IIIA: Bố, Ai, Inh, Tai (B, AI, GA, IN, TI)
Nhóm IV: Chú, Sỉ, Gọi em, Sang nhắm, Phở Bò (C, SI, GE, SN, PB)
Nhóm V: Nhà, Phương, Ăn, Sống, Bí (N, P, AS, SB, BI)
Nhóm VI: Ông, Say, Sỉn, Té, Bò (O, S, SE, TE, PO)
Nhóm VII: Phải, Chi, Be, Yêu, Anh (F, CI, BR, L, AT)
Nhóm VIII: Hằng, Nga, Ăn, Khúc, Xương, Rồng (HE, NE, AR, KR, XE, RN)
Bảng tuần hoàn hóa học của Mendeleev
Bảng tuần hoàn là một phương pháp dạng bảng để hiển thị các nguyên tố hóa học do nhà hóa học người Nga Dimitri Mendeleev phát minh vào năm 1869. Mục đích của bảng là minh họa xu hướng tuần hoàn trong tính chất của các nguyên tố. Thiết kế của bảng tuần hoàn đã được tinh chỉnh và mở rộng khi nhiều nguyên tố mới được phát hiện theo thời gian.
Giá trị quan trọng của bảng tuần hoàn là khả năng dự đoán các tính chất hóa học của một nguyên tố theo vị trí của nó trong bảng. Các thuộc tính của các phần tử là khác nhau nếu chúng được xem theo chiều dọc qua cột bảng hoặc theo chiều ngang dọc theo các hàng. Bảng tuần hoàn này được sử dụng rộng rãi trong lĩnh vực hóa học cũng như vật lý, kỹ thuật và công nghiệp. Bảng tuần hoàn hóa học là kiến thức đầu tiên cần được học của những người mất căn bản môn hóa học.
1. Bảng tuần hoàn hóa học lớp 8
Nằm trong chương trình Hóa học lớp 8, là năm đầu tiên học sinh nhận được môn Hóa học nên các em đều rất bỡ ngỡ. Thay vì chọn phương pháp cho học sinh tiếp xúc ngay với bảng tuần hoàn, trước hết Bộ GD & ĐT và các chuyên gia trong ngành giáo dục cho học sinh nhận thức các bài toán khác nhau liên quan đến bảng tuần hoàn. Điều này sẽ giúp học sinh liên hệ với các khái niệm cơ bản, hiểu bản chất của vấn đề một cách riêng lẻ và sau đó khái quát nó trong bảng tuần hoàn các nguyên tố hóa học.
Một số chủ đề có sẵn cho học sinh lớp 8 sẽ bao gồm:
• Nguyên tử: Làm rõ các chủ đề nguyên tử là gì? Hạt nhân nguyên tử là gì? Giới thiệu chung về các lớp electron trong nguyên tử.
• Nguyên tố hóa học: Làm rõ các vấn đề như nguyên tố hóa học là gì? Một số bài toán liên quan đến khối lượng nguyên tử hoặc có bao nhiêu nguyên tố hóa học?
2. Bảng tuần hoàn hóa học lớp 9
Đến với môn Hóa học lớp 9, các em sẽ có cái nhìn tổng quát hơn về bảng tuần hoàn. Với những tiền đề được rút ra từ Hóa học 8, các em đã có thể tiếp thu một lượng kiến thức vừa đủ để tích hợp thêm kiến thức Hóa học 9 vào trí não của mình.
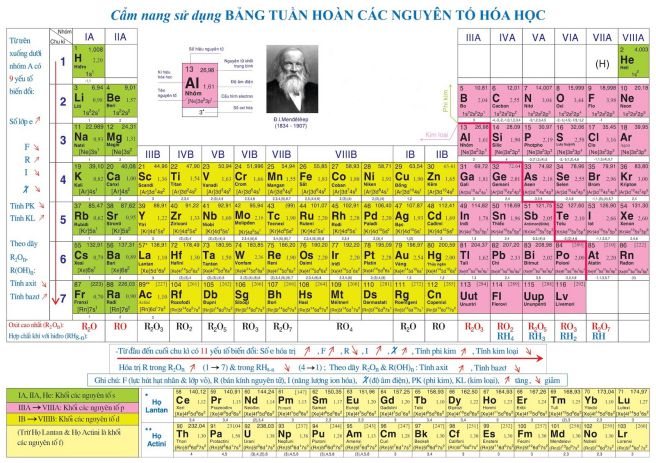
Ở môn Hóa học 9, các em học sinh có cái nhìn chính xác và ngắn gọn hơn về bảng tuần hoàn bao gồm:
• Tổng hợp một số kiến thức về bảng tuần hoàn các nguyên tố hóa học, bao gồm nguồn gốc của bảng tuần hoàn. Nguyên tắc tổ chức các nguyên tố trong bảng tuần hoàn, cấu trúc bảng tuần hoàn, sự thay đổi tính chất của các nguyên tố trong bảng tuần hoàn và cuối cùng là ý nghĩa của bảng tuần hoàn các nguyên tố hóa học.
• Ngoài ra, các em còn được học thêm các bài ôn tập và các phần luyện tập khác nhau liên quan đến bảng tuần hoàn các nguyên tố hóa học để các em nắm chắc kiến thức, nhớ lâu kiến thức.
3. Bảng tuần hoàn hóc học lớp 10
Sau khi học xong bảng tuần hoàn các nguyên tố hóa học, vào lớp 10 môn Hóa học, việc học sinh nắm vững kiến thức về bảng tuần hoàn là điều vô cùng cần thiết, các em nắm được số hiệu của các nguyên tố hóa học cũng là điều bắt buộc tên của các mục trong bảng tuần hoàn.
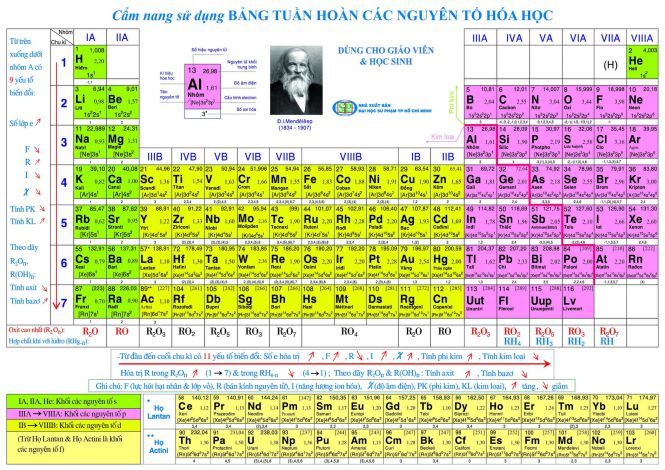
Trong kiến thức Hóa học lớp 10 hiện nay chúng ta chỉ đi sâu vào bảng tuần hoàn đặc biệt ở một số môn học như: Nguồn gốc phát minh ra bảng tuần hoàn, nguyên tắc tổ chức các nguyên tố trong bảng tuần hoàn, cấu trúc bảng tuần hoàn và cuối cùng là các bài tập cơ bản nâng cao.
Ở cấp độ này, học sinh bắt buộc phải biết vận dụng bảng tuần hoàn hóa học vào bài tập để thực hiện bài tập một cách nhẹ nhàng, thống nhất, nó cũng có thể được áp dụng thành thạo trong thực hành hàng ngày của học sinh.